Tirzepatide e Alcolismo: il farmaco per diabete riduce il desiderio
Un promettente studio pre-clinico suggerisce che la Tirzepatide, già usata per l’obesità, possa agire sui centri del piacere, aprendo una strada inaspettata per la cura delle dipendenze.
Il Disturbo da Uso di Alcol (AUD), comunemente noto come alcolismo, rappresenta una delle sfide sanitarie e sociali più complesse e devastanti a livello globale. Purtroppo, le armi farmacologiche a disposizione dei medici per contrastare questa dipendenza sono attualmente limitate, spesso con efficacia parziale o effetti collaterali che ne rendono difficile l’impiego a lungo termine. C’è un bisogno medico insoddisfatto enorme.
Tuttavia, una speranza inaspettata arriva da un settore della medicina apparentemente distante: la cura del metabolismo.
Uno studio recente, condotto dai ricercatori dell’Università di Göteborg in Svezia e pubblicato sulla prestigiosa rivista scientifica Nature – Scientific Reports, ha evidenziato come la Tirzepatide – un farmaco innovativo già approvato per il trattamento del diabete di tipo 2 e per la gestione dell’obesità – sia in grado di ridurre drasticamente il consumo volontario di alcol.
È fondamentale sottolineare subito che si tratta di uno studio pre-clinico, condotto cioè su modelli animali (roditori) e non ancora su pazienti umani per questa specifica indicazione. Ma i risultati sono così netti da aver acceso l’entusiasmo della comunità scientifica internazionale.
LA SCHEDA DELLO STUDIO IN SINTESI
Per comprendere la portata e i limiti di questa scoperta, ecco una sintesi visiva dei punti chiave della ricerca.
[INSERIRE QUI L’IMMAGINE GENERATA]
- La Molecola: Tirzepatide. È un farmaco “doppio agonista” che mima l’azione di due ormoni intestinali (GLP-1 e GIP), potenti regolatori della glicemia e della sazietà.
- L’Ipotesi di partenza: Se questi ormoni comunicano al cervello un senso di “pienezza” e gratificazione dopo un pasto, possono anche ridurre la “fame chimica” di alcol?
- I Protagonisti dello Studio: Roditori (Ratti e Topi, sia maschi che femmine) che avevano sviluppato comportamenti di dipendenza dall’alcol.
- Lo Stato dell’Arte: La ricerca è in fase sperimentale pre-clinica. Non è ancora una terapia approvata per l’alcolismo umano.
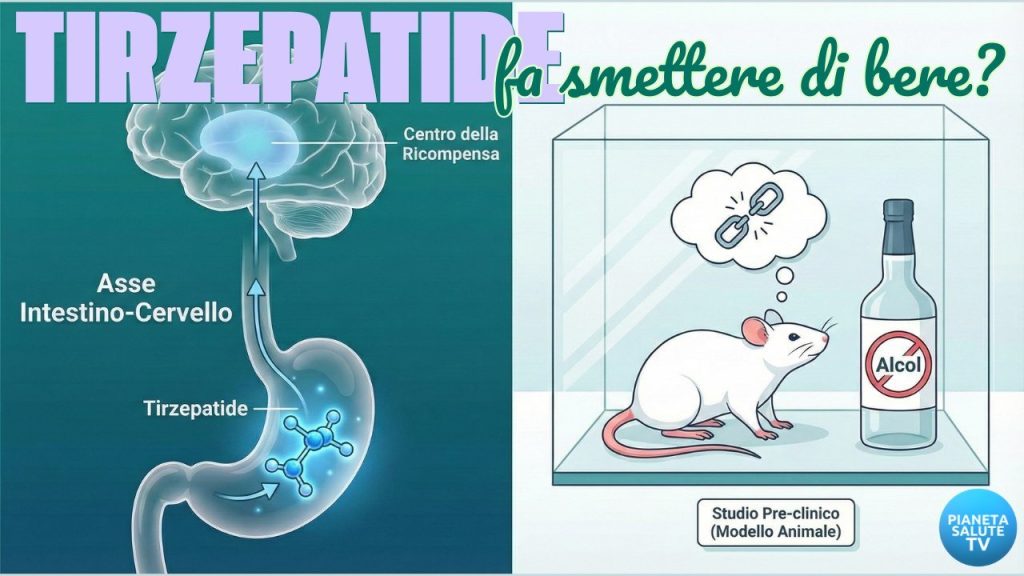
Perché questa ricerca è così importante? (L’asse intestino-cervello)
La scoperta rafforza un concetto che sta rivoluzionando la medicina moderna: il potente legame tra il nostro apparato digerente e il nostro sistema nervoso centrale, noto come asse intestino-cervello.
La Tirzepatide non si limita a lavorare nel pancreas per abbassare lo zucchero nel sangue. La molecola viaggia nel corpo e raggiunge recettori specifici situati anche nel cervello. Questi recettori non regolano solo la fame di cibo, ma sono profondamente intrecciati con il sistema di gratificazione.
L’idea che un farmaco nato per il diabete possa curare una dipendenza si basa sul concetto di “drug repurposing” (riposizionamento del farmaco). Scoprire che una molecola già esistente, e di cui conosciamo già il profilo di sicurezza sull’uomo, possa avere effetti su una patologia diversa, accelererebbe di anni la possibilità di avere nuove cure disponibili per i pazienti.
Cosa hanno scoperto esattamente i ricercatori?
Lo studio svedese è stato molto approfondito, analizzando diversi comportamenti legati all’alcol nei roditori. La somministrazione di Tirzepatide ha portato a una serie di risultati concordanti e sorprendenti:
- Crollo del consumo volontario: Gli animali trattati col farmaco hanno semplicemente smesso di cercare l’alcol, preferendo l’acqua, con una riduzione significativa delle quantità assunte rispetto al gruppo di controllo.
- Stop al “Binge Drinking”: Uno degli aspetti più pericolosi dell’alcolismo è l’assunzione rapida di grandi quantità di alcol in breve tempo. Il farmaco ha drasticamente ridotto questi episodi di “abbuffata alcolica”.
- Blocco delle ricadute: Forse il dato più promettente. Anche dopo un periodo di astinenza forzata, quando l’animale veniva nuovamente esposto all’alcol (una situazione che solitamente scatena una forte ricaduta), la Tirzepatide ha impedito il ritorno al consumo compulsivo.
Come funziona il meccanismo nel cervello?
La domanda chiave è: come fa un ormone intestinale a far passare la voglia di bere? I ricercatori hanno indagato cosa accadeva nel cervello degli animali.
L’alcol, come molte sostanze d’abuso, provoca un rilascio massiccio di dopamina nel Nucleus Accumbens, un’area cerebrale che possiamo considerare il “centro del piacere e della ricompensa”. Questa inondazione di dopamina è ciò che il cervello cerca compulsivamente nella dipendenza.
Lo studio suggerisce che la Tirzepatide agisca come un modulatore, una sorta di “interruttore dimmer” su questo sistema. Agendo sui suoi recettori nel cervello, il farmaco sembra normalizzare il rilascio di dopamina nel Nucleus Accumbens. In parole semplici: quando l’animale assume alcol, non prova più quell’intensa ondata di piacere chimico. L’alcol diventa meno gratificante, meno “necessario” per il cervello, spezzando il circolo vizioso della dipendenza.
Dallo studio alla realtà: quali sono i prossimi passi per i pazienti?
Nonostante l’entusiasmo, la cautela è d’obbligo. Il cervello umano è infinitamente più complesso di quello di un roditore, e la dipendenza da alcol nell’uomo è influenzata anche da fattori psicologici e sociali che non possono essere replicati in una gabbia di laboratorio.
Il fatto che la Tirzepatide sia già approvata per l’uso umano (per diabete e obesità) è un enorme vantaggio, perché sappiamo che è generalmente sicura. Tuttavia, prima che possa essere prescritta da un medico per l’alcolismo, dovranno essere condotti trial clinici specifici (Fase 2 e Fase 3) su pazienti umani affetti da Disturbo da Uso di Alcol.
Questi studi dovranno confermare se l’efficacia vista nei topi si replica nell’uomo e definire i dosaggi corretti. La strada è ancora lunga, ma la direzione tracciata da questo studio potrebbe cambiare per sempre il modo in cui trattiamo le dipendenze.
Fonte: Tirzepatide reduces alcohol drinking and relapse-like behaviours in rodents. Edvardsson, Christian E. et al.; eBioMedicine, Volume 124, 106119