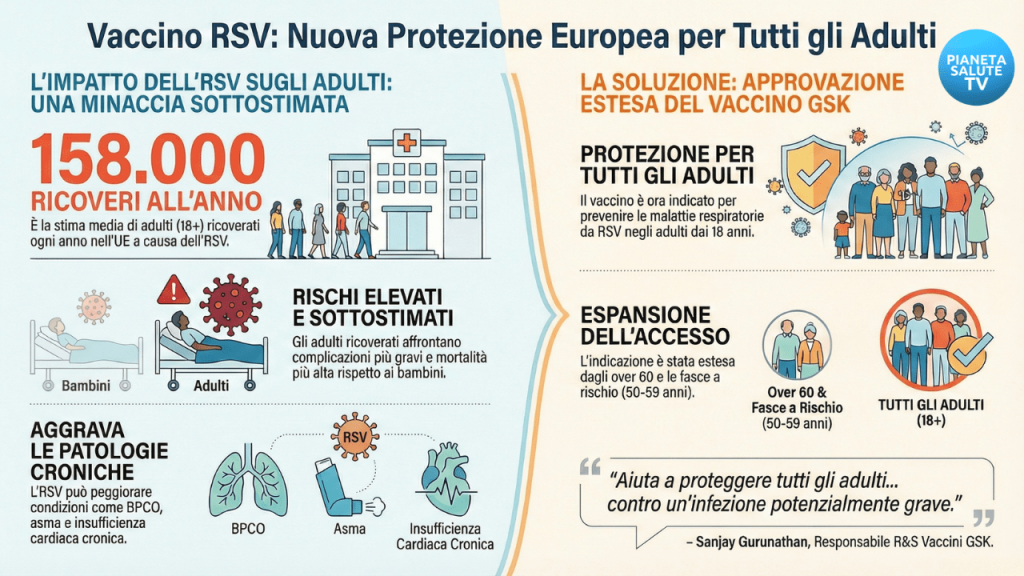
Virus Respiratorio Sinciziale: l’UE approva il vaccino GSK per tutti gli adulti dai 18 anni in su
La Commissione Europea ha dato il via libera all'estensione dell'utilizzo del vaccino ricombinante adiuvato contro il virus respiratorio sinciziale (RSV) di GSK.